 | запись на прием |  |  |  |
| Официальный сайт врача дерматовенеролога Агапова С.А. | +7(903) 406-40-89 | |||
| А | Б | В | Г | Д | И | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Э | Я |
Не существует единого этиологического фактора для развития меланомы. Самым значимым фактором риска спорадических (ненаследственных) форм меланомы кожиследует считать воздействие на кожу ультрафиолетового излучения типа В (длина волны 290 - 320 нм) и типа А (длина волны 320-400 нм). При этом чувствительность кожи культрафиолетовому воздействию различается у людей и может быть классифицирована на 6 типов,
В 2014 году в Российской Федерации меланомой кожи заболело 9493 человека. Грубый показатель заболеваемости (оба пола) составил 6,
Злокачественная меланома кожи(С43,
- C43.0 Злокачественная меланома губы
- C43.1 Злокачественная меланома века,
включая спайку век - C43.2 Злокачественная меланома уха и наружного слухового прохода
- C43.3 Злокачественная меланома других и неуточненных частей лица
- C43.4 Злокачественная меланома волосистой части головы и шеи
- C43.5 Злокачественная меланома туловища (включая кожу перианальной области,
кожу ануса и пограничную зону, кожу грудной железы - C43.6 Злокачественная меланома верхней конечности,
включая область плечевого сустава - C43.7 Злокачественная меланома нижней конечности,
включая область тазобедренного сустава - C43.8 Злокачественная меланома кожи,
выходящая за пределы одной и более выше указанных локализаций - C43.9 Злокачественная меланома кожи неуточненная
- Злокачественные новообразования полового члена неуточненной локализации (C60.9)
- Злокачественные новообразования мошонки (C63.2)
- Злокачественное новообразование вульвы (C51)
Метастазы меланомы без выявленного первичного очага:
- Вторичное и неуточненное злокачественное новообразование лимфатических узлов (C77.0 - C77.9) (для случаев впервые выявленных метастазов меланомы в лимфатические узлы без выявленного первичного очага)
- Вторичное злокачественное новообразование органов дыхания и пищеварения (C78)
- Вторичное злокачественное новообразование других локализаций (C79)
- Вторичное злокачественное новообразование кожи (C79.2)
- Вторичное злокачественное новообразование головного мозга и мозговых оболочек (C79.3)
Первичная меланома других локализаций:
- Злокачественное новообразование глаза и его придаточного аппарата (C69)
- Злокачественные новообразования органов пищеварения (C15-C26)
- Злокачественные новообразования женских половых органов (C51-C58)
- поверхностно-распространяющаяся меланома кожи
- меланома кожи по типу злокачественного лентиго
- узловая меланома кожи
- подногтевая меланома кожи
- акрально-лентигинозная меланома кожи
Морфологические типы не оказывают самостоятельного влияния на прогноз течения болезни (только через связь с толщиной опухоли по Бреслоу и изъязвление опухоли),
Меланома поверхностно распространяющаяся
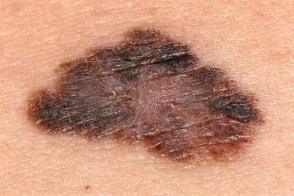 Самая частая злокачественная опухоль меланоцитарного происхождения у белого населения, Самая частая злокачественная опухоль меланоцитарного происхождения у белого населения, На внешне неизмененной коже появляется пятно (или уплощенная папула) диаметром 2—3 мм, Поверхность очага поражения по мере роста опухоли становится неровной, Локализация любая.Опухоль возникает чаще всего в верхней части спины у обоих полов, |
Лентиго-меланома
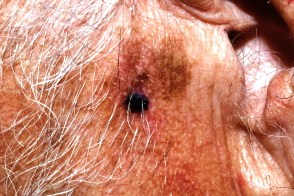 Злокачественная опухоль меланоцитарного происхождения, Злокачественная опухоль меланоцитарного происхождения,Злокачественное лентиго, Очаг поражения имеет неправильную форму, Новообразование чаще всего локализуется на открытых участках кожи : лицо, |
Меланома узловая
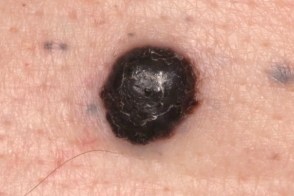 Злокачественная опухоль меланоцитарного происхождения, Злокачественная опухоль меланоцитарного происхождения,Развитие узловой меланомы начинается сразу с фазы вертикального роста. Опухоль равномерно приподнята над уровнем кожи и представляет собой толстую бляшку, Очаг поражения на ранних стадиях имеет размеры 1-3 см, Локализуется в основном на участках тела сравнительно редко подвергающихся действию солнечных лучей. У женщин часто обнаруживаются на голенях |
Ладонно-подошвенная меланома
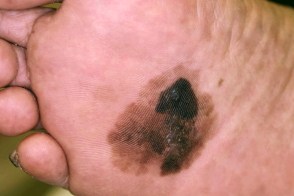 Акральная лентигинозная меланома, Акральная лентигинозная меланома, |
Меланома подногтевая
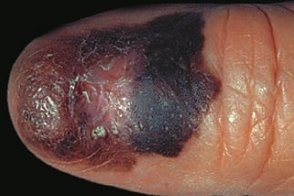 Акральная лентигинозная меланома в области ногтевого ложа, Акральная лентигинозная меланома в области ногтевого ложа,Пальцы рук поражаются в 2 раза чаще, Характеризуется подногтевым пятном или продольными полосами коричневого или темно-синего цвета, Течение меланомы на пальцах ног более доброкачественное, |
Меланома слизистой полости рта
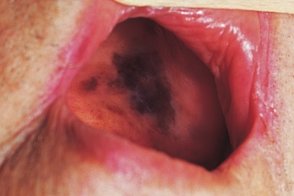 Частота поражения полости рта составляет 2, Частота поражения полости рта составляет 2, |
Меланома глаз
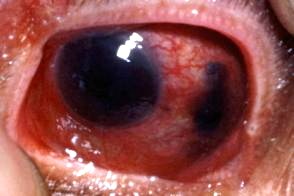 Меланома глаза является вторым наиболее распространенным типом после меланомы кожи и наиболее распространенной первичной внутриглазной злокачественной опухолью у взрослых.Различают частую форму - увеальную меланому с поражением радужной оболочки, Меланома глаза является вторым наиболее распространенным типом после меланомы кожи и наиболее распространенной первичной внутриглазной злокачественной опухолью у взрослых.Различают частую форму - увеальную меланому с поражением радужной оболочки, |
Меланома полового члена
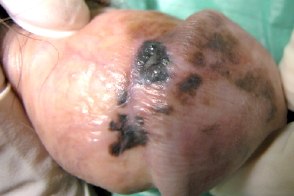 Очень редкая форма меланомы, Очень редкая форма меланомы, |
Меланома вульвы
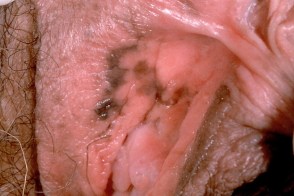 Меланома вульвы составляет от 3 до 6% среди всех меланом .Чаще возникает у женщин, Меланома вульвы составляет от 3 до 6% среди всех меланом .Чаще возникает у женщин,Предрасполагающие факторы дистрофии, |
Аноректальная меланома
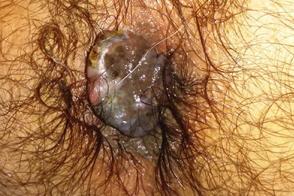 Частота составляет 1, Частота составляет 1, |
Меланома беспигментная
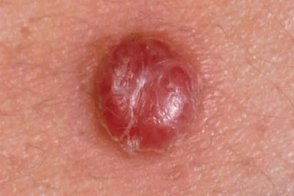 Злокачественная меланоцитарная опухоль (меланома ахроматическая), Злокачественная меланоцитарная опухоль (меланома ахроматическая), |
Десмопластическая меланома
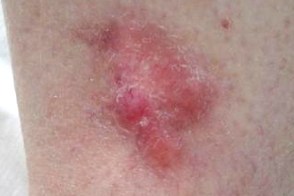 Злокачественная меланоцитарная опухоль, Злокачественная меланоцитарная опухоль,Встречается в возрасте
30—90 лет (средний возраст 56 лет),
Из-за отсутствия характерных клинических признаков и четких границ диагноз десмопластической меланомы обычно ставят поздно.После иссечения десмопластической меланомы у половины больных развиваются местные рецидивы, |
Меланома нейротропная
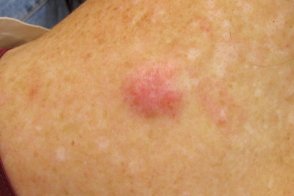 Злокачественная меланоцитарная опухоль с вовлечением в патологический процесс нервных стволов.По клиническим признакам ничем не отличается от десмопластической меланомы, Злокачественная меланоцитарная опухоль с вовлечением в патологический процесс нервных стволов.По клиническим признакам ничем не отличается от десмопластической меланомы, |
Детская меланома
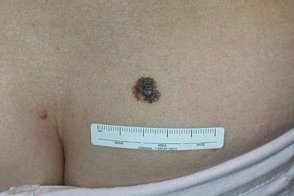 Меланому у детей разделяют на инфантильную (с момента рождения до однолетнего возраста), Меланому у детей разделяют на инфантильную (с момента рождения до однолетнего возраста),В 50-92% случаев меланома у детей развивается на месте врожденных гигантских меланоцитарных невусов в течение первых 5 лет жизни, На здоровой коже меланома у детей практически не развивается.Иногда опухоль может развиваться у детей с диспластическими меланоцитарными невусами, Детская меланома редкое заболевание и наблюдается в 0, Меланомы, |
Врожденная меланома
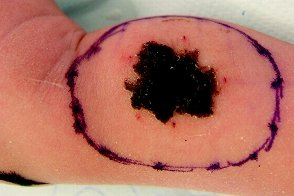 Очень редкая форма меланомы, Очень редкая форма меланомы, |
Меланома шпицподобная
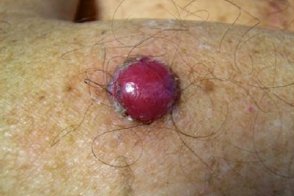 Злокачественная меланоцитарная опухоль, Злокачественная меланоцитарная опухоль, |
Меланома невоидная
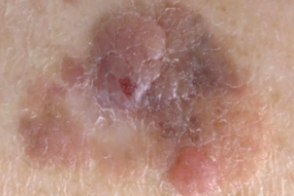 Редкий вариант меланомы, Редкий вариант меланомы, |
Полипоидная меланома
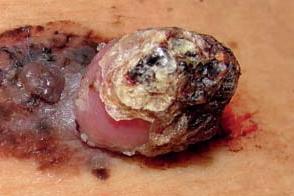 Редкий подтип меланомы кожи, Редкий подтип меланомы кожи, |
Меланома метастатическая
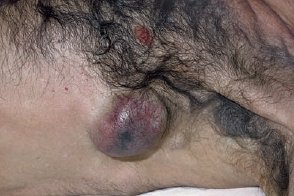 Метастазы и рецидивы меланомы могут появиться как в отдаленных участках кожи, Метастазы и рецидивы меланомы могут появиться как в отдаленных участках кожи, |
Для процедуры стадирования меланомы гистологическое подтверждение обязательно. Оценку состояния лимфатических узлов для установления стадии выполняют при помощи клинического осмотра и инструментальных исследований.
Уровни Кларка (Clark)
I уровень — клетки меланомы находятся в пределах эпидермиса и характер инвазии соответствует меланоме in situ;
II уровень — опухоль разрушает базальную мембрану и инвазирует верхние отделы сосочкового слоя дермы;
III уровень — клетки меланомы заполняют весь сосочковый слой дермы,
IVуровень — инвазия сетчатого слоя дермы;
V уровень — инвазия подлежащей жировой клетчатки
Толщина меланомы по Бреслоу (Breslow)
Расстояние от верхнего края опухоли до максимально глубокого её слоя.- Опухоль,
имеющая толщину дермального компонента менее 0, 75 мм; - 0,
75 мм – 1, 5 мм; - 1,
51 мм – 3, 0 мм; - 3,
0 мм – 4, 0 мм; - Более 4,
0 мм
Критерий Т
Отражает распространенность первичной опухоли. Классификация по критерию Т возможна только после удаления первичной опухоли и ее гистологического исследования:
- рТХ - недостаточно данных для оценки первичной опухоли (включая случаи спонтанной регрессии опухоли,
а также ошибки при хирургическом удалении опухоли). - рТ 0- отсутствие первичной опухоли
- pT i s - меланома in situ (уровень инвазии по Кларку I) (атипическая меланоцитарная гиперплазия,
тяжелая меланоцитарная дисплазия, неинвазивная злокачественная опухоль). - рТ1- опухоль толщиной по Бреслоу < 1 мм
- рТ1а - уровень инвазии по Кларку II или III без изъязвления опухоли
- рТ 1b- уровень инвазии по Кларку IV или V или наличие изъязвления опухоли
- рТ2 - опухоль толщиной по Бреслоу1 мм и < 2 мм рТ2а - без изъязвления опухоли рТ2b- наличие изъязвления опухоли
- рТ 3- опухоль толщиной по Бреслоу2 мм и < 4 мм рТ3а- без изъязвления опухолирТ3b- наличие изъязвления опухоли
- рТ 4- опухоль толщиной по Бреслоу4 мм рТ4а- без изъязвления опухоли рТ4b- наличие изъязвления опухоли
Критерий N
Указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах.Регионарными лимфатическими узлами следует считать для опухолей,
- Голова,
шея: ипсилатеральные околоушные, подчелюстные, шейные и надключичные лимфатические узлы - Грудная стенка: ипсилатеральные подмышечные лимфатические узлы
- Верхняя конечность: ипсилатеральные локтевые и подмышечные лимфатические узлы
- Живот,
поясница и ягодицы: ипсилатеральные паховые лимфатические узлы - Нижняя конечность: ипсилатеральные подколенные и паховые лимфатические узлы
- Край ануса и кожа перианальной области: ипсилатеральная паховые лимфатические узлы
- В случае расположения опухоли в пограничных зонах лимфоузлы с обеих сторон могут считаться регионарными.
Анатомические ориентиры пограничных зон для определения регионарных лимфатических бассейнов
| Области | Линия границы (шириной 4 см) |
| Левая и правая половины | Срединная линия тела |
| Голова и шея / грудная стенка |
Ключица - акромион - верхний край плеча |
| Грудная стенка / верхняя конечность | Плечо - подмышечная впадина - плечо |
|
Грудная стенка / живот, или ягодицы |
Спереди: середина расстояния между пупком и реберной дугой; Сзади: нижняя граница грудного позвонка (поперечный отросток) |
|
Живот, нижняя конечность |
Паховая складка - большой вертел -я годичная борозда |
|
При обнаружении метастазов в лимфатических узлах за пределами указанных регионарных зон метастазирования следует классифицировать их как отдаленные метастазы. |
|
| Nx - недостаточно данных для оценки регионарных лимфатических узлов. N 0- поражения регионарных лимфатических узлов нет | |
- N 1 - метастаз в 1 регионарном лимфатическом узле.
- N 1a- микрометастазы в 1 регионарном лимфатическом узле (клинически,
включая инструментальные методы диагностики и визуализации, не определяемые). - N 1b- макрометастазы в 1 регионарном лимфатическом узле (определяемые клинически,
включая инструментальные методы диагностики ивизуализации). - N 2- метастазы в 2-3 регионарных лимфатических узлах или только сателлитные или транзитные метастазы
- N 2a- микрометастазы в 2-3 регионарных лимфатических узлах (клинически,
включая инструментальные методы диагностики и визуализации, неопределяемые). - N 2b- макрометастазы в 2-3 регионарных лимфатических узлах (определяемые клинически,
включая инструментальные методы диагностики и визуализации). - N 3- метастазы более чем в 3 регионарных лимфатических узлах,
или конгломераты лимфатических узлов, или сателлитные/транзитные метастазы при наличии метастазов врегионарных лимфатических узлах.
Сателлитами называют опухолевые отсевы или узелки (макро- или микроскопические) в пределах 2 см от первичной опухоли. Транзитными метастазами называют метастазы в кожу или подкожную клетчатку на расстоянии более 2 см от первичной опухоли но не распространяющиеся за пределы регионарных лимфатическихузлов.
Критерий М
Характеризует наличие или отсутствие отдаленных метастазов
- М 0- отдаленных метастазов нет.
- М 1- наличие отдаленных метастазов.
- М1а- метастазы в кожу,
подкожную клетчатку или лимфатические узлы (за исключением регионарных) при нормальном уровне ЛДГ крови; - М1bметастазы в легкие при нормальном уровне ЛДГ крови;
- М 1с - метастазы в любые другие органы,
или любая локализация метастазов при уровне ЛДГ выше верхней границы нормального диапазона.
Метастазы меланомы кожи без выявленного первичного очага в периферические лимфоузлы одного региона следует стадировать как III стадию (III Tx)
Стадии меланомы
| Стадия | Критерий Т | Критерий N | Критерий M |
| 0 | pT i s | N0 | M0 |
| I A | рТ1а | N0 | M0 |
| I B | рТ 1b | N0 | M0 |
| рТ2a | N0 | M0 | |
| II A | рТ2b | N0 | M0 |
| рТ3а | N0 | M0 | |
| II B | pТ3b | N0 | M0 |
| Т4а | N0 | M0 | |
| II C | рТ4b | N0 | M0 |
| III A | рТ1а - рТ4a | N1a или N2a | M0 |
| III B | рТ1b - рТ4b | N1a или N2a | M0 |
| рТ1а - рТ4a | N1b или N2b | M0 | |
| рТ1а - рТ4a | N2c | M0 | |
| III C | рТ1b - рТ4b | N1b или N2b | M0 |
| рТ1b - рТ4b | N2c | M0 | |
| рТ любое | N3 | M0 | |
| IV | рТ любое | любая N | любая M1 |
Физикальное обследование
Рекомендуется сбор жалоб и анамнеза у пациента с целью выявления факторов,
Осмотр пациента рекомендуется проводить врачам,
Правило ABCD
| Asymmetry | Асимметрия | Одна половина очага не похожа на другую половину |
| Border irregularity | Беспорядочные (неровные) очертания |
Границы очага зубчатые, |
| Colour variegation | Цветовые вариации | Различные цвета и различные оттенки цвета |
| Diameter | Диаметр более 6 мм | Измеряют по самой длинной оси очага |
7-точечная система распознавания меланом
| 1 | Change in size |
Изменение размеров, |
| 2 | Change in shape |
Изменение формы, |
| 3 | Change in color | Изменение цвета |
| 4 | Inflammation | Воспаление |
| 5 | Crusting or bleeding | Образование корки или кровоточивость |
| 6 | Sensory change |
Изменение ощущений, |
| 7 | Diameter | Диаметр более 7 мм |
Правило «ФИГАРО» — шесть признаков меланомы
- Форма выпуклая — приподнятая над уровнем кожи,
что лучше всего видно при боковом освещении. Меланома in situ и акрально-лентигинозная меланома бывают плоскими - Изменение размеров,
ускорение роста — один из самых важных признаков меланомы - Границы неправильные — опухоль имеет «изрезанные» края
- Асимметрия — одна половина опухоли не похожа на другую
- Размеры крупные — диаметр опухоли обычно превышает диаметр карандаша (6 мм)
- Окраска неравномерная — беспорядочно расположенные коричневые,
черные, серые, розовые и белые участки
По результатам анализа жалоб,
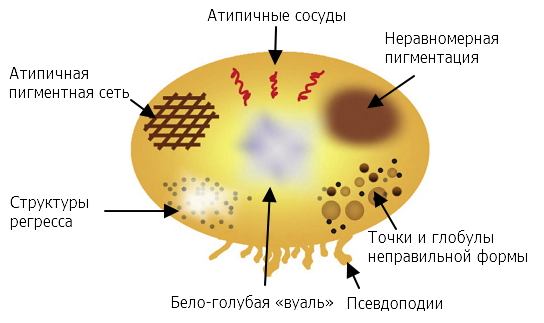
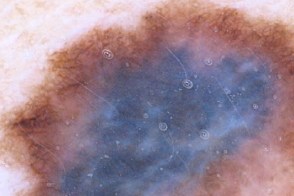
Дерматоскопия
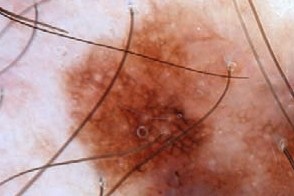 |
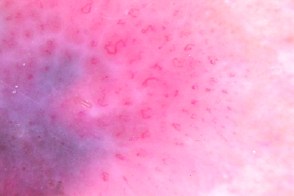 |
| Атипичная пигментная сеть | Атипичные сосуды |
 |
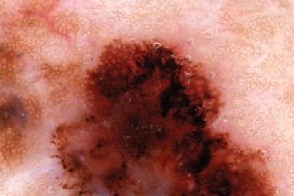 |
| Бело-голубая вуаль | Неравномерная пигментация |
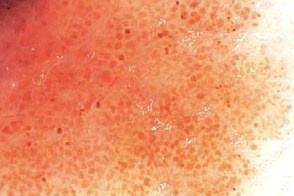 |
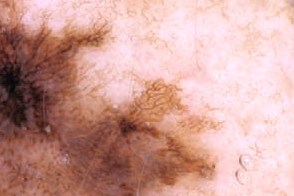 |
| Неправильные точки и глобулы | Псевдоподии |
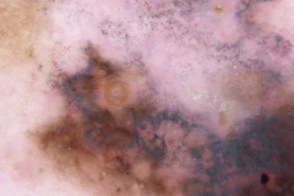 |
|
| Структуры регресса |
Лабораторная диагностика
До морфологического подтверждения диагноза лабораторная диагностика не рекомендуется,
Инструментальная диагностика
При наличии соответствующих показаний (симптомов) диагностические мероприятия (включая лучевую диагностику) проводят в полном объеме внезависимости от стадии заболевания. В отсутствие симптомов для выявления скрытых метастазов рекомендовано выполнять диагностические тесты различногообъема в зависимости от стадии заболевания (установленной по данным клинического осмотра и гистологического заключения),
При подтверждении диагноза меланома кожи по данным биопсии рекомендованные диагностические мероприятия суммированы в таблице ниже.
План обследования в зависимости от результатов биопсии пигментного новообразования кожи и клинического осмотра
| Стадия |
Инструментальная диагностика |
Лабораторная диагностика |
Биопсия сторожевого лимфоузла |
Молекулярно генетические тесты |
|
0, |
УЗИ регионарных лимфоузлов Лучевая диагностика не рекомендуется, если нет симптомов |
Нет |
Да (при толщине опухоли 1, |
Нет |
|
IIB, |
УЗИ регионарных лимфоузлов Лучевая диагностика вполном объеме МРТ головного мозга с в/в контрастом (для стадии III) |
ЛДГ, Общий и биохимический анализы крови |
Да (для стадии IIB, |
тест на мутацию BRAF может быть предложен |
| IV |
УЗИ регионарных лимфоузлов Лучевая диагностик в полном объеме МРТ головного мозга с в/вконтрастом (для cтадии III) |
ЛДГ, биохимический анализы крови |
Нет |
тест на мутацию BRAF обязателен (при меланоме кожи), при отсутствии мутации в гене BRAF -тест на мутацию в гене CKIT |
До морфологического подтверждения диагноза инструментальная диагностика не рекомендуется,
Рекомендуется выполнять оптимальный объем лучевой диагностики: для оценки состояния органов грудной,
- Выполнение КТ головного мозга без внутривенного контрастирования не рекомендуется.
- Рекомендуется выполнить МРТ головного мозга в течение 2 мес. после гистологического подтверждения диагноза «меланома кожи» стадия IIB и выше .
- Рекомендуется выполнить остеосцинтиграфию при подозрении на метастатическое поражение костей скелета.
- Рекомендуется выполнить биопсию под контролем УЗИ/КТ при подозрении на метастазы по данным КТ или МРТ в случаях,
когда их подтверждение принципиально меняет тактику лечения.
Биопсия
Для подтверждения диагноза,
Рекомендуется ориентировать разрезы кожи в направлении ближайшего лимфатического коллектора параллельно лимфатическим сосудам кожи (а не покожным линиям или естественным складкам),
Эксцизионная биопсия подозрительного плоского пигментного образования кожи может быть безопасно выполнена с использованием местной инфильтрационной анестезии. При этом рекомендуется избегать повреждений удаляемого новообразования до его иссечения
В случае подтверждения диагноза меланомы кожи рубец после биопсии иссекается с большим отступом в сроки до 4-8 недель в зависимости от гистологических характеристик опухоли .
Гистологическое исследование
Рекомендуется проводить гистологическое исследование хирургически удаленного опухолевого препарата,
Обязательные характеристики:
- определение максимальной толщины опухоли в мм по Бреслоу;
- определение уровня инвазии по Кларку;
- указание о наличии или отсутствии изъязвления первичной опухоли;
- определение митотического индекса (количество митозов на 1 мм2) притолщине опухоли до 1 мм включительно;
- оценка периферического и глубокого краев резекции на наличиеопухолевых клеток
- наличие транзиторных или сателлитных метастазов;
Дополнительные характеристики:
- локализация опухоли
- наличие или отсутствие спонтанной регрессии
- нейротропизм;
- десмоплазия;
- лимфоидная инфильтрация
- гистологичсекий подтип
- ангиолимфатическая инвазия
Критерии гистологического диагноза меланомы:
- гетерогенная популяция клеток;
- наличие участков выраженного полиморфизма;
- высокая клеточность опухоли с тесным расположением клеток;
- наличие атипичных митозов,
а также митозов в глубоких участках опухоли; - выраженная воспалительная реакция .
Гистологических типы меланомы:
- Эпителиоподобный тип представлен клетками больших размеров округлой или полигональной формы,
всегда с обильной слегка розоватой цитоплазмой, в которой часто имеется большое количество глыбчато- го пигмента. Ядра клеток крупные, неправильной округлой формы, с четкими ядрышками, выраженным полиморфизмом и гиперхромией. Клетки располагаются рыхло, скоплениями и нередко содержат коричневатые гранулы пигмента меланина. Весьма характерны митозы. - Веретеноклеточный тип представлен клетками вытянутой формы с удлиненными ядрами,
которые полиморфны по интенсивности окраски и размерам. Цитоплазма светло-розовая, содержит мелкие пылевидные гранулы пигмента меланина. Клетки, формируя рыхлые пучковые структуры, имеют тенденцию к диссоциации, т. е. обычно не происходит плотного прилегания друг к другу. - Невоклеточный (мелкоклеточный) тип характеризуется клетками небольших размеров круглой формы с крупным ядром,
занимающим всю клетку, так что цитоплазмы почти не видно или она прослеживается в виде узкого ободка. Пигмента в клетках почти не содержится. Митозы трудно различимы. Клетки представляются не связанными между собой и располагаются как бы тесными группами. Меланомы невоклеточного варианта отличаются сложностью при дифференциальной диагностике с внутридер- мальным невусом. - Смешанно-клеточный тип различные комбинации эпителиоподобного,
веретеноклеточного и невоклеточного типов.
Гистологические особенности некоторых форм меланом:
- Поверхностно-распространяющаяся меланома.На срезе,
проходящем через плоскую часть опухоли, определяются крупные атипичные меланоциты, похожие на клетки Педжета. Они располагаются по всей толще эпидермиса, поодиночке или гнездами (меланоцитарной дисплазии педжетоидного типа). Узел образован очень крупными атипичными меланоцитами с обильной цитоплазмой, в которой нередко видны равномерно распределенные мелкие гранулы меланина. Иногда в узлах встречаются веретенообразные и мелкие атипичные меланоциты. Атипичные меланоциты иммуногистохимически окрашиваются на белок S100 и на антиген меланоцитов НМВ 45. - Лентиго-меланома.Меланоциты в опухоли,
как правило, атипичные, разнообразной формы, располагаются в один ряд вдоль базального слоя эпидермиса. Местами атипичные меланоциты проникают в дерму, образуя в ней крупные гнезда. Характерно раннее поражение эпителия поверхностных участков придатков кожи, особенно волосяных фолликулов - Узловатая меланома.Опухоль берет начало на границ эпидермиса и дермы,
откуда сразу же начинается инвазия опухолевых клеток в дерму (вертикальный рост). Радиальный рост практически отсутствует, и внутриэпидермальный компонент опухоли представлен лишь небольшой группой клеток. На срезе, проходящем в стороне от узла, атипичных меланоцитов в эпидермисе нет. В опухоли могут присутствовать крупные эпителиоидные клетки, веретенообразные клетки и мелкие атипичные меланоциты либо смесь этих трех видов клеток Атипичные меланоциты иммуногистохимически окрашиваются на белок S100 и на антиген меланоцитов НМВ 45. - Ладонно-подошвенная меланома.Характерна выраженная лимфоцитарная инфильтрация на границе дермы и эпидермиса. Крупные отростчатые меланоциты располагаются вдоль базального слоя эпидермиса и нередко проникают в дерму по ходу протоков мерокриновых потовых желез,
образуя большие гнезда. Атипичные меланоциты в дерме обычно имеют веретенообразную форму, поэтому гистологически напоминает десмопластическую меланому. - Подногтевая меланома.Отличается большой толщиной (средняя толщина опухоли после ее удаления составляет 4,
8 мм и в 79% случаев уровень инвазии по Кларку - IV). - Беспигментная меланома.Опухоль быстро прорастает подлежащие ткани (жировую клетчатку),
отличается значительной толщиной . В клетках опухоли даже при самой тщательной световой микроскопии нельзя обнаружить никаких признаков пигмента меланина. Для верификации диагноза необходимы гистохимические окраски, выявляющие неокрашенные предшественники меланина (ДОФА-реакция, реакция Фонтана-Массона и др.) или иммуногистохимические исследования - Меланома десмопластическая.Пролиферация атипичных меланоцитов на границе эпидермиса и дермы. Меланоциты расположены беспорядочно или образуют гнезда. Картина напоминает злокачественное лентиго. Опухоль образована пучками вытянутых клеток,
напоминающих фибробласты, которые разделены прослойками соединительной ткани. Плеоморфизм клеточных элементов обычно мало выражен, митозов мало. Определяются участки с выраженной дифференцировкой в сторону шванновских клеток и неотличимы от шванномы. Опухоль характеризуется значительной глубиной.В коллагеновом матриксе разбросаны веретенообразные клетки, которые иммуногистохмически окрашиваются на белок S100. В этих клетках иногда обнаруживают свободные меланосомы и премеланосомы. В краевой части опухоли встречаются небольшие скопления лимфоцитов.Для десмопластической меланомы характерен нейротропизм: опухолевые клетки, похожие на фибробласты, расположены внутри эндоневрия и вокруг мелких нервов. Толщина опухоли, как правило, превышает 2 мм. Обычно находят сопутствующие изменения, характерные для тяжелого повреждения кожи солнечными лучами. - выраженная пролиферация фибробластов наряду с незначительной (или вообще отсутствующей) пролиферацией атипичных меланоцитов на границе эпидермиса и дермы;
- нейротропизм,
то есть сосредоточение роста опухоли вокруг нервных волокон; - наличие в коллагеновом матриксе веретенообразных клеток,
иммуногистохимически окрашиваемых на белок S100 (окрашивание на антиген меланоцитов НМВ 45 может быть отрицательным). - Нейротропная меланома.
По существу является веретеноклеточной или десмопластической меланомой.Помимо распространения по периневральным пространствам и вовлечения нервов в опухолевый процесс,
имеет очевидную невральную дифференцировку.Она представлена полями опухоли, где веретенообразные клетки имеют перекрученные ядра и как бы вставлены в фибрознук строму
Иная диагностика
При меланоме кожи и метастазах меланомы без выявленного первичного очага рекомендуется выполнить анализ биоптата опухоли (или ранее удаленных л/у илипервичной опухоли [если материал удовлетворяет требованиям лаборатории для достоверного определения наличия или отсутствия молекулярно-генетических изменений]) на мутацию в гене BRAF (15 экзон),
При отсутствии мутации в гене BRAF рекомендуется выполнить анализ биоптатаопухоли на мутацию в гене CKIT (8,
При меланоме слизистых оболочек рекомендуется выполнить анализ биоптата опухоли на мутацию в гене в гене CKIT (8,
Поверхностно-распространяющаяся меланома
- Доброкачественные невусы
- Атипичные (диспластические) невусы
- Себорейный кератоз
- Солнечное лентиго.
Лентиго-меланома
- Распространяющийся пигментированный актинический кератоз
- Болезнь Боуэна
- Солнечное лентиго.
- Себорейный кератоз -цвет может быть таким же темным,
но опухоль представлена только папулами или бляшками с характерной бородавчатой поверхностью, на которой видны мелкие углубления и роговые кисты; при поскабливании возникает шелушение. - Старческое лентиго,
подобно злокачественному лентиго, представляет собой пятно, но не бывает таким неравномерно и интенсивно окрашенным, черный и темно-коричневый цвета нехарактерны.
Узловатая меланома
- Приобретенный невоклеточный невус
- Невус Шпиц
- Себорейный кератоз может иметь темную или черную окраску,
что делает такие эпидермальные опухоли похожими на меланому. Кроме того, меланома может возникать на фоне существующей бородавчатой формы врожденного меланоцитарного невуса, поверхность которого испещрена трещинами, что тоже придает внешнее сходство с себорейным кератозом. Узловая меланома отличается тем, что она быстрее растет, а также может кровоточить. У себорейного кератоза существует патогномоничный признак, которым является появление на поверхности образования множественных закупоренных волосяных фолликулов — роговых кист . Наибольшую трудность в дифференциальной диагностике представляет такая форма себорейного кератоза, как меланоакантома. Она напоминает меланому из-за своей сильной пигментации - Венозная гемангиома,
как и узловая меланома, может возникать у больных старше 50 лет. Данная доброкачественная сосудистая опухоль чаще располагается на лице, губах или ушных раковинах в виде опухолевидного образования черно-синей окраски . Однако у меланомы преобладает черный оттенок, а у гемангиомы синий. Особенно трудна дифференциальная диагностика между этими двумя опухолями по расположению венозной гемангиомы не на лице . - Пиогенная гранулема,
как и узловая меланома, может иметь вид опухолевидного образования красно-коричневого цвета. Однако при меланоме преобладают оттенки коричневого и черного, а при пиогенной гранулеме — красного. Кроме того, последняя легко кровоточит и отличается очень быстрым развитием (может вырасти в течение одной недели) - Саркома Капоши,
как и узловая меланома может быть представлена одним узлом красно-коричневого цвета. Однако первое заболевание редко проявляется только одним элементом и при тщательном осмотре кожного покрова oбнаруживаются другие очаги поражения. Kpoме того, при саркоме Капоши преобладает синюшно-красный цвет, а при меланоме — коричневый и черный. - Травмированная кавернозная гемангиома
- Капиллярный тромб (тромбоз) поверхностно расположенного сосуда кожи,
как и узловая меланома, представлен узлом или узелком однородного черного или темно-синего цвета.Капиллярный тромб имеет гладкую поверхность, четкие границы, мягковатую консистенцию при пальпации, напоминает тромбированную гемангиому. Новообразование изначально быстро увеличивается в течение 1—2 дней, а затем не меняется в размерах. Воспаление кожи вокруг образования, как правило, отсутствует. - Ангиокератома
- Пигментированный базально-клеточный рак (более твердая консистенция)
- Голубой невус (появляется в детстве)
- Ангиофиброму и гистиоцитому легко отличить от меланомы на основании значительной плотности и ограниченности очагов поражения,
их очень медленного (годами) развития. Эти ново- онрпзования имеют округлую форму, редко выступают над уровнем кожи, а как бы впаяны в нее. Кроме того, при ангиофиброме в процессе диаскопии изменяется насыщенность цвета опухоли — она бледнеет, чего не наблюдается при меланоме.
Подногтевая меланома
- Продольная меланонихия
- Меланоцитарный невус
- Пиогенная гранулема
- Подногтевая гематома - подобно меланоме,
она сохраняется в течение года и более, однако по мере роста ногтя темный участок постепенно смещается к свободному краю. Дифференциальный диагноз прост, если прибегнуть к эпилюминесцентной микроскопии (точность метода превышает 95%).Для меланомы характерно распространение пигмента в саму пластинку ногтя, в кутикулу и на дорсальную поверхность пальца. - Онихомикоз (если разрушена ногтевая пластинка или имеется пигментация или кровоизлияние)
Ладонно-подошвенная меланома
Подошвенная
бородавка - при осмотре меланомы под лампой Вуда видно,
Десмопластическая меланома
- Злокачественная шваннома (анапластическая неврилеммома)
- Голубой невус
- Клеточный голубой невус
- Дерматофиброма
- Нейрофиброма
- Рубец
- Невус Шпиц
Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения больных меланомой кожи 0-III стадии .По показаниям дополнительно проводится адъювантная терапия
Лечение локальных стадий заболевания (I-II)
Рекомендуется выполнять радикальное иссечение первичной опухоли в пределах здоровых тканей как основой этап лечения локальной меланомы кожи.
Выбор хирургического отступа формируется на основании результатов морфологического исследования,
- 0,
5 см для меланомы in situ; - 1,
0 см при толщине опухоли по Breslow< 2 мм; - 2,
0 см при толщине опухоли2 мм .
Модифицированные варианты резекции с меньшими отступами возможны для сохранения функции органа при меланоме кожи пальцев или кожи ушной раковины .
Рекомендуется для определения толщины опухоли на первом этапе использовать эксцизионную биопсию пигментного образования с отступом не более 0,
Если эксцизионная биопсия не проводится из-за очевидности диагноза,
Не рекомендуется рутинное выполнение профилактической лимфаденэктомии или проведение предоперационной лучевой терапии как на регионарные лимфатические узлы,
Биопсия сторожевого лимфатического узла проводится в специализированных учреждениях,
В отсутствие возможности выполнения БСЛУ рекомендуется максимально тщательно исследовать регионарные лимфоузлы,
Лечение меланомы кожи III стадии
Пациенты с меланомой кожи III стадии представляют собой неоднородную группу пациентов с точки зрения лечебной тактики. С практической точки зренияследует различать резектабельный процесс и нерезектабельныйместнораспространенный процесс (включая конгломераты лимфоузлов и/илитранзитные или сателлитные метастазы - клинические варианты IIIB или IIIC стадии). Рекомендуется выполнить адекватное иссечение первичной опухоли (если не было выполнено ранее) .
Рекомендуется выполнять регионарную лимфаденэктомию всем пациентам срезектабельной меланомой кожи III стадии.
Пациентам,
При проведении лимфаденэктомии больным меланомой кожи III стадии рекомендуетсявыполнять максимально полное удаление клетчатки анатомической области,
При клинически определяемом поражении глубоких паховых лимфатических узлов большое внимание следует уделить наружным подвздошнымлимфатическим узлам. Некоторые исследователи в случае массивного поражения глубоких паховых лимфатических узлов (более 3) или поражении узла Пирогова-Розенмюллера-Клоке рекомендуют расширять объем операции до удаления ипсилатеральных
наружных подвздошных лимфатических узлов,
Рекомендуется определять следующие параметры при гистологическом исследовании метастазов меланомы в регионарные лимфоузлы.
- количество удаленных лимфатических узлов;
- количество пораженных лимфатических узлов;
- характер поражения лимфатических узлов:
- S частичное поражение (количество лимфатических узлов);
- S полное поражение (количество лимфатических узлов);
- S прорастание капсулы (количество лимфатических узлов).
Рекомендуется предлагать пациентам после радикальной лимфаденэктомии при отсутствии противопоказаний адъювантную иммунотерапию,
Рекомендуется предлагать пациентам с высоким риском регионарного рецидива послерадикальной лимфаденэктомии при отсутствии противопоказаний профилактическую послеоперационную лучевую терапию на область пораженного лимфоколлектора,
По данным проведенных исследований послеоперационная лучевая терапия снижает риск регионарного рецидива у больных с высоким риском,
- вовлечение в опухолевый процесс 4 и более лимфатических узлов;
- прорастание метастаза за пределы капсулы лимфатического узла;
Исследованный режим лучевой терапии в данном случае составлял 48 Гр за 20 фракций в течение не более 30 дней .
Для определения показаний к назначению адъювантной терапии рекомендуетсяоценить риск прогрессирования и смерти от меланомы кожи послерадикального хирургического лечения. Для оценки риска рекомендуетсяиспользовать классификацию TNM AJCC/UICC 2009 которая включает в себя основные прогностические факторы.
Рекомендуется предлагать пациентам с высоким и промежуточным риском прогрессирования после радикального хирургического лечения (т.е. больными со стадиями ПВ-Ш,
К настоящему моменту показано,
- Не рекомендуется в рутинной практике (вне рамок клинических исследований) в адъювантном режиме использовать другие препараты,
кроме препаратов ИФН альфа, включая ипилимумаб. - Для пациентов,
радикально оперированных по поводу отдаленных метастазов меланомы кожи, в настоящее время не разработано. Рекомендовано проводить таким пациентам динамическое наблюдение или предлагать участие вклинических исследованиях (если таковые имеются). - Не рекомендуется проводить адъювантную терапию ИФН альфа больным МК благоприятного прогноза,
имеющим низкий риск прогрессированиязаболевания (IA, IB, IIA стадии).[ - Не рекомендуется проводить адъювантную терапию ИФН альфа больным МК,
укоторых риски, связанные с развитием нежелательных явлений на фоне применения ИФН, перевешивают ожидаемую пользу .
Учитывая,
- Тяжелая депрессия
- Цирроз печени любой этиологии
- Аутоиммунные болезни
- Выраженная органная недостаточность (сердечная,
печеночная, почечная и др.) - Беременность или планируемая беременность
- Псориаз
Неспособность пациента адекватно выполнять назначения врача В связи с этим,
Данные по безопасности и эффективности адъювантного применения ИФН альфа при меланоме кожи у лиц моложе 18 лет ограничены единичными наблюдениями,
Рекомендовано начинать адъювантную иммунотерапию в сроки не позже 9 недель с момента хирургического лечения после полного заживления послеоперационной раны. Не рекомендуется начинать адъювантное лечение в том случае,
При удовлетворительной переносимости (и отсутствии признаков прогрессирования основного заболевания) максимальная рекомендуемая длительность лечения составляет 12 месяцев.
Рекомендуемые режимы иммунотерапии для адъювантного лечения меланомы кожи
| Дозы | Индукционная фаза | Поддерживающая фаза |
| Высокие |
Интерферон альфа 2b 20 млн/м2 в/в в 1-5 дни х 4нед. |
Интерферон альфа 2b 10 млн/м2 п/к х 3 р/нед х 11мес. |
| Низкие |
Интерферон альфа 2 a, |
|
Учитывая отсутствие данных об эффективности других режимов назначения ИФН альфа,
В настоящее время не существует доказательств преимущества высоких доз ИФН альфа перед низкими,
По данным многочисленных международных исследований применение химиотерапии в адъювантном режиме после радикального лечения меланомы кожи IIb-III стадии неприносит клинической пользы.Нерекомендуется использоватьхимиотерапию в рутинной практике для адъювантного лечения меланомы кожи.
Не рекомендуется использовать индукторы ИФН,
Рекомендации по адъювантному лечению меланомы кожи
| Стадия | TNM | Риск | *1Рекомендуемое адъювантное лечение' |
| IA | T1a | низкий |
Адъювантное лечение не рекомендуется в связи со степенью риска |
| IB | T1b | ||
| IIA | T2a | ||
| T2b | |||
| T3a | |||
| IIB | T3b | Промежуточный |
A. ИФН альфа 3-5 млн Ед п/к х 3 р/нед. х 12 мес. B. ИФН альфа 20 млн Ед/м2 в/в в дни 1-5 х 4 нед., далее 10 млнЕд/м2 п/к 3 р/нед.х 11 мес. |
| T4a | |||
| IIC | T4b | Высокий |
A. ИФН альфа 20 млн Ед/м2 в/в в дни 1-5 х 4 нед., х 11 мес. B. ИФН альфа 3-5 млн Ед п/к х 3 р/нед . х 12 мес. |
| IIIA |
N1a-N2a при Т1-4а |
Промежуточный |
A. ИФН альфа 3-5 млн Ед п/к х 3 р/нед . х 12 мес. B. ИФН альфа 20 млн Ед/м2 в/в в дни 1-5 х 4 нед., далее 10 млн Ед/м2п/к 3 р/нед. х 11 мес. |
| IIIB |
N1a N2a при T1-4b |
Высокий |
A. ИФН альфа 20 млн Ед/м2 в/в в дни 1-5 х 4 нед., далее 10 млн Ед/м2п/к 3 р/нед. х 11 мес. B. ИФН альфа 3-5 млн п/к Ед х 3 р/нед. х 12 мес. |
|
N1b- N2b при Т1-4а |
|||
| IIIC |
N1b-N2 при T1-4b |
||
| N3 | |||
| IV | M1a-c | Сверхвысокий |
Эффективность адъювантного лечения не доказана |
* Порядок расположения режимов (А,
Пациентам всех групп следует предлагать участие в клинических исследованиях при наличии таковых в данном лечебном учреждении
Общие принципы выбора терапии первой линии у больных метастатической или неоперабельной меланомой кожи
На выбор терапии первой линии у больных метастатической или неоперабельной меланомой кожи оказывает влияние множество факторов:биологические особенности заболевания,
Рекомендуется провести тщательное определение распространенности заболевания(«стадирование») заболевания в объеме МРТ головного мозга с в/в контрастом (не более 4 недель после установки диагноза); КТ органов грудной полости или (если не может быть проведено в течение 2 недель после установки диагноза) рентгенография органов грудной клетки; КТ органов брюшной полости и малого таза с в/в контрастом или (если не
может быть проведено в течение 2 недель после установки диагноза) УЗИ органов брюшной полости и малого таза; УЗИ периферических лимфоузлов,
Убедительных сведений об улучшении выживаемости при применении ПЭТ-КТ вместо КТ как для оценки первичной распространенности,
Рекомендуется выполнить развернутый общий и биохимический анализы крови сопределением уровня лактатдегидрогеназы.
Рекомендуется выполнить оценку состояния пациента по шкале ВОЗ/ECOG ,
Рекомендуется провести молекулярно-генетическое исследование опухоли на наличие мутаций в 15 экзоне гена BRAF. Для исследования может быть использован архивный опухолевый материал или свежий материал,
При отсутствии мутации в гене BRAF (“дикий тип”) рекомендуется выполнить анализ биоптата опухоли на мутацию в гене CKIT (8,
При отсутствии возможности выполнить молекулярно-генетическое исследованиеопухоли на наличие мутации в гене BRAF (или CKIT) в течение 4 недель послеустановления диагноза метастатической меланомы (отсутствует материал для анализа,
Выбор терапии первой линии у больных метастатической или неоперабельной меланомой кожи с мутацией в гене BRAF
У пациентов с мутацией в гене BRAF V600 в первой линии терапии рекомендуетсяиспользовать либо монотерапию анти-PD1,
У пациентов с большой опухолевой массой и высокой скоростью прогрессирования заболевания следует отдавать предпочтение комбинации ингибиторов BRAF и МЕК
- Не рекомендуется проводить терапию ингибиторами BRAF или комбинацией ингибиторов BRAF и MEK пациентам с неизвестным статусом опухоли в отношении мутации в гене BRAF,
так как имеются сведения о возможности парадоксальной активации ERK-сигнального пути и ускорения роста опухоли при применении ингибиторов BRAF на клеточных линиях без мутации в гене BRAF . - Не рекомендуется комбинирование ингибитора BRAF и ингибитора МЕК разных производителей,
так как такие комбинации изучены недостаточно.
Учитывая особый профиль дерматологических нежелательных явлений этих препаратов,
При проведении ингибиторами BRAF или комбинацией ингибиторов BRAF и МЕК оценку эффекта лечения рекомендовано проводить каждые 8-10 недель не допуская перерывов в приеме препарата на период оценки эффекта лечения. Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики,
Режимы назначения ингибиторов BRAF и МЕК
| Схема терапии | Препарат | Доза | Дни приема | Длительность |
| Комбинированная | Вемурафениб Кобиметиниб |
960 мг 2 раза в день 60 мг1 раз в сутки |
ежедневно | длительно |
|
с 1 по 21 день, 7 дней перерыв |
длительно | |||
| Комбинированная | Дабрафениб |
150 мг 2 раза в день |
ежедневно | длительно |
| Траметиниб |
2 мг 1 раз всутки |
ежедневно | длительно | |
| Монотерапия | Вемурафениб |
960 мг 2 раза в день |
ежедневно | длительно |
| Монотерапия | Дабрафениб |
150 мг 2 раза в день |
ежедневно | длительно |
При наличии признаков прогрессирования заболевания на фоне применения ингибиторов BRAF или комбинации ингибиторов BRAF и МЕК,
Режимы применения блокаторов рецепторов PD1
|
Схема терапии |
Препарат | Доза |
Путь введения |
Дни введения |
Длительность |
| Монотерапия | ниволумаб |
3 мг/кг массы тела (но не более 240 мг) |
в/в капельно 60 мин |
1 раз в 14 дней |
длительно |
| Монотерапия | пембролизумаб |
2 мг/кг массы тела (но не более 200 мг) |
в/в капельно 30 мин |
1 раз в 21 день |
длительно |
При наличии признаков прогрессирования заболевания на фоне применения ингибиторов BRAF переключение пациентов на комбинированную терапию нерекомендуется,
При наличии признаков прогрессирования заболевания на фоне применения одного из ингибиторов BRAF или одной из комбинаций ингибитора BRAF и МЕК не рекомендуется переключать пациентов на другой ингибитор BRAF или другую комбинацию ингибитора BRAF и МЕК. Имеющиеся преклинические данные позволяютпредположить аналогичные механизмы действия и формирования резистентности к вемурафенибу/кобиметинибу и дабрафенибу/траметинибу . Сведения о наличии клинической эффективности подобного переключения также отсутствуют.
При медленно прогрессирующей метастатической и/или местно распространенной меланоме (III неоперабельная - IV стадии) у пациентов с ожидаемой продолжительностью жизни не менее 6 мес. при отсутствии противопоказаний,
Ипилимумаб является ингибитором антигена 4 цитотоксического Т-лимфоцита (CTLA 4) и относится к категории иммуно-онкологических препаратов. Ипилимумаб используется в дозе 3 мг/кг в/в в виде 90-минутной инфузии каждые 3недели (1,
Режим применения блокатора рецептора CTLA4 при меланоме кожи
|
Схема терапии |
Препарат | Доза |
Путь введения |
Дни введения |
Длительность цикла, режим |
| Монотерапия | ипилимумаб |
3 мг/кг массы тела |
в/в капельно 90 мин |
1 раз в 21 день |
максимум 4 введения |
При невозможности проведения терапии (или сроками ожидания начала такой терапии более 1 мес.) ингибиторами BRAF или комбинацией ингибиторов BRAF иМЕК или ингибиторами рецепторов PD1 или CTLA4 в первой или во второй линииу пациентов с метастатической или нерезектабельной меланомой и мутацией в гене BRAF в опухоли при сохранении удовлетворительного общего состояния пациента(ECOG 0-2) и ожидаемой продолжительности жизни более 3 мес. рекомендуется проведение цитотоксической химиотерапии.
Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни,
Режимы химиотерапии,
| Схема терапии | Препарат | Доза |
Путь введения |
Дни приема |
Длительность цикла, дни, режим |
| Монотерапия | Дакарбазин | 1000 мг/м2 | в/в | 1-й | 21 -28 |
| Монотерапия | Дакарбазин | 250 мг/м2 | в/в | 1-й -5-й | 21 -28 |
| Монотерапия | Темозоломид | 200 мг/м2 |
внутрь или в/в |
1-й -5-й | 28 |
| Комбинация | Цисплатин | 20 мг/м2 | в/в | 1-4 | |
| Винбластин | 2 мг/м2 | 1-4 | 28 | ||
| Дакабазин | 800 мг/м2 | 1 | |||
| Комбинация | Паклитаксел | 175 мг/м2 | в/в | 1 | 21 |
| Карбоплатин | 225 мг/м2 | 1 | |||
| Монотерапия |
Арабинопиран- озилметил итрозомочевина |
1000 мг |
в/в медленно |
день 1-3 | 28-35 |
При проведении химиотерапии оценку эффекта лечения рекомендовано проводить послекаждого 2-3-го цикла (каждые 7-12 недель). Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики,
Выбор терапии первой линии у больных метастатической или неоперабельной меланомой кожи с мутацией в гене CKIT
У пациентов с мутацией в гене CKIT в качестве терапией первой линии рекомендованалибо монотерапия анти-PDl,
Режим применения иматиниба при меланоме кожи
| Схема терапии | Препарат | Доза |
Путь введения |
Дни введения |
| Монотерапия | иматиниб | 400 мг 2 р/сут | внутрь | ежедневно |
Оценку эффекта терапии рекомендовано проводить не реже 1 раза через каждые 8-10 недель терапии,
Не рекомендуется проводить терапию иматинибом пациентам с неизвестным статусом опухоли в отношении мутации в гене CKIT,
При наличии признаков прогрессирования заболевания на фоне применения иматиниба,
При невозможности проведения терапии (или сроками ожидания начала такой терапии более 1 мес.) иматинибом или ингибиторами рецепторов PD1 или CTLA4 в первой или вовторой линии у пациентов с метастатической или нерезектабельной меланомой с мутацией в гене CKIT в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и ожидаемой продолжительности жизни более 3 мес. возможно проведение цитотоксической химиотерапии.
Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни,
Выбор терапии первой линии у больных без мутаций в генах BRAF илиCKIT
У больных без мутаций в генах BRAF или CKIT при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и ожидаемой продолжительности жизни более 3 мес. оптимальным вариантом терапии следует считать модуляторы иммунологического синапса - блокаторы рецептора PD1 .
При очевидном прогрессировании болезни на фоне терапии блокаторами рецепторов PD1 у пациентов с ожидаемой продолжительностью жизни не менее 6 мес. при отсутствии противопоказаний,
При очевидном прогрессировании болезни на фоне терапии одним из блокаторов рецептора PD1 нет никаких научных оснований для переключения пациентов на другой блокатор рецепторов PD1 . Имеющиеся преклинические данные позволяют предположить аналогичные механизмы действия и формирования резистентности книволумабу и пембролизумабу. Сведения о наличии клинической эффективности подобного переключения также отсутствуют.
При невозможности проведения терапии (или сроками ожидания начала такой терапии более 1 мес.) ингибиторами рецепторов PD1 или CTLA4 в первой или во второй линии у пациентов с метастатической или нерезектабельной меланомой безмутаций в гене BRAF или CKIT в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и ожидаемой продолжительности жизни более 3 мес. рекомендуется проведение цитотоксической химиотерапии .
Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни,
Особенности оценки ответа на лечение модуляторами
Модуляторы иммунологического синапса (ингибиторы рецептора PD1или CTLA4) представляют собой принципиально новый класс лекарственных препаратов,
Рекомендуется проводить первоначальную радиологическую оценку ответа на лечение проводится не ранее 12 недель от начала терапии (при отсутствии клинического ухудшения состояния пациента). Повторные исследования проводятся через 8-12 недель(при отсутствии клинического ухудшения состояния пациента) .
Рекомендуется использовать модифицированные критерии ответа на лечение,
Ингибиторы рецептора PD1 применяются в постоянном режиме с интервалом 2 (ниволумаб) или 3 (пембролизумаб) недели до наступления прогрессирования или непереносимости,
Однако по данным проведённых исследований отмена терапии у пациентов,
Лечение пациентов с особыми клиническими формами локальной и местно распространенной меланомы кожи
При местнора спространенной форме меланомы кожи с изолированным поражением конечности в отдельных специализированных центрах (ФГБУ «РОНЦ им. Н.Н. Блохина»,
При обширных по площади поражениях кожи лица (меланома по типу злокачественноголентиго) для пациентов,
На сегодняшний день нет единого мнения относительно частоты и интенсивности наблюдения за больными с меланомой кожи.
Всем больным рекомендуется избегать солнечных ожогов,
Рекомендованы ежегодные физикальные осмотры с тщательной оценкой состояния кожных покровов.
Больные с низким риском прогрессирования (I-IIA стадии) Рекомендованы физикальные осмотры с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов каждые 6 мес. в течение 5 лет,
- Наблюдение за данной группой больных,
не имеющих клинических признаков заболевания, рекомендовано не реже 1 раза в 3 мес. в течение 2 лет, затем каждые 6 мес. втечение 3 лет, затем ежегодно. Обследование включает в себя: - физикальные осмотры с тщательной оценкой состояния кожных покровов ипериферических лимфатических узлов;
- инструментальное обследование (РГ ОГК,
УЗИ органов брюшной полости, периферических и отдаленных лимфоузлов); по показаниям: КТ органов грудной клетки, КТ/МРТ органов брюшной полости; - у пациентов с впервые выявленными отдаленными метастазами рекомендовано выполнение МРТ головного мозга с в/в контрастированием для исключения метастатического поражения головного мозга.
Задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов,
| Клинические и дерматоскопические признаки меланомы 7 пунктов |
Имеются противопоказания.Проконсультируйтесь с врачом | 18+ |
| AgapovMD.ru © 2012 All rights reserved Официальный сайт врача дерматолога-венеролога Агапова С.А. Прием:344023 г.Ростов-на-Дону,пр-т Ленина,251 тел.+7(903) 406-40-89,+7(928) 121-89-41 email:agapovmd@gmail.com |
|